由大阪大学领导的研究人员现在已经确定了一种机制,通过这种机制,可以将缺乏胰岛素的情况反馈给产生胰岛素的胰腺细胞,从而确定糖尿病的潜在新治疗靶点。
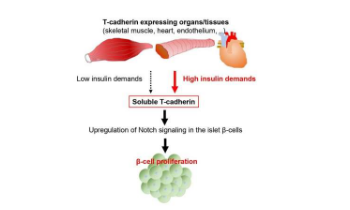
据估计,2 型糖尿病影响全球超过 4 亿人,但体内的胰岛素调节仍不完全清楚。当胰腺无法提供足够的胰岛素(一种控制糖使用和储存的激素)来满足生理需求时,就会发生 2 型糖尿病。如果身体对胰岛素的需求没有得到满足,胰腺中产生胰岛素的细胞(称为 β 细胞)通常会增殖以增加其数量。然而,目前尚不清楚接受胰岛素的组织或细胞会释放哪些因子来向胰腺β细胞发出胰岛素缺乏的信号。
在iScience上发表的一项研究中,研究人员发现一种称为 T-钙粘蛋白的分子可能参与向产生胰岛素的胰腺细胞提供反馈并控制它们的增殖。
T-钙粘蛋白通常存在于细胞表面,最出名的是作为脂联素分子的结合伙伴,脂联素是一种由储存脂肪的细胞特异性分泌的因子。然而,研究人员表明,T-钙粘蛋白也以以前未描述的可溶形式分泌,并且可以作为体液因子,即通过循环系统运输的分子。
他们不仅认识到 T-cadherin 对胰岛素缺乏有反应,而且还证明了经过基因改造而缺乏 T-cadherin 的小鼠在喂食高脂肪饮食时会降低葡萄糖耐量。
“用于研究全基因组基因表达水平的 RNA 测序分析显示,在缺乏 T-钙粘蛋白的小鼠的 β 细胞中,Notch 信号蛋白的表达降低,”主要作者 Tomonori Okita 和通讯作者 Shunbun Kita 解释说。这些蛋白质在被认为促进 β 细胞增殖的 Notch 信号通路中发挥作用;这表明可溶性 T-钙粘蛋白通过 Notch 途径向胰腺 β 细胞发出信号以增加胰岛素的产生。
“然后,我们使用人工合成的 T-钙粘蛋白来治疗分离的小鼠胰岛,这些胰岛是包含 β 细胞的胰腺部分,”资深作者 Iichiro Shimomura 解释说。“这种治疗促进了小鼠胰岛中的 Notch 信号传导,进而诱导 β 细胞增殖。” 这些发现表明T-钙粘蛋白可用于糖尿病的基础治疗。
